Article
Feb 11, 2026
Guia completo do participante de estudos clínicos de bioequivalência
Entenda como funcionam os estudos clínicos de bioequivalência, quem pode participar, quais os benefícios e como se inscrever com segurança na Synvia.
Os estudos clínicos de bioequivalência fazem parte de uma etapa importantíssima para garantir que medicamentos genéricos cheguem ao mercado com a mesma segurança, qualidade e assertividade do medicamento de referência (originais).
São esses estudos que permitem que milhões de pessoas tenham acesso a tratamentos confiáveis por preços mais acessíveis — e a participação de voluntários saudáveis é o que torna tudo isso possível.
A Synvia é líder em pesquisas clínicas na América Latina, com uma equipe formada por mais de 800 profissionais e um dos maiores parques analíticos do continente.
Durante 20 anos de atuação, já fizemos muitas contribuições para a assertividade e melhoria dos medicamentos disponíveis nas farmácias de cada canto do Brasil:
+1.800 estudos realizados +30.000 participantes 15 mil m² de infraestrutura |
Esses números mostram a escala, a responsabilidade e a seriedade que envolvem cada estudo conduzido pela empresa. Quer entender mais sobre o assunto? Continue a leitura!
Como funcionam os estudos clínicos de bioequivalência?
Os estudos clínicos de bioequivalência são conduzidos com pessoas saudáveis para comparar a velocidade e a quantidade com que o medicamento genérico e o medicamento de referência (original) são absorvidos pelo organismo.
É por meio desses testes que se comprova que ambos medicamentos se comportam da mesma forma no corpo — garantindo que o genérico seja tão seguro e qualificado quanto o original.
Esses estudos clínicos também oferecem aos participantes a oportunidade de contribuir diretamente para a saúde pública e, ainda, receber uma compensação financeira por seu tempo e colaboração.
Você quer ajudar a validar medicamentos genéricos e receber uma compensação pela sua contribuição? Clique aqui.

Quem pode participar das pesquisas de bioequivalência?
Podem participar dos estudos clínicos de bioequivalência pessoas saudáveis, maiores de idade e que atendam aos critérios definidos para cada protocolo. Os principais requisitos incluem:
Ser maior de 18 anos de idade. | Estar em boas condições físicas. | Não fazer uso de medicamentos contínuos, salvo aprovação médica. |
Não ter histórico de doenças graves. | Não estar gestante ou amamentando (no caso de mulheres). | Estar disposto a cumprir jejum, coletas e horários estabelecidos. |
A confirmação dessa elegibilidade é feita durante a triagem clínica, etapa que garante segurança para todos os envolvidos.
Clique aqui e fique entre os primeiros a serem chamados para novos estudos de bioequivalência.
Antes do estudo de bioequivalência: como se preparar?
Antes de participar dos estudos clínicos de bioequivalência, é importante entender que algumas etapas de preparação garantem a sua segurança e a qualidade dos resultados.
A seguir, você confere exatamente o que fazer antes desse momento e como se preparar para que tudo ocorra da melhor forma possível. Vamos lá?
Preparação para a triagem
A preparação para a triagem é simples, mas fundamental para garantir que os seus exames reflitam com precisão o seu estado de saúde. Pequenos cuidados nos dias anteriores ajudam a evitar alterações nos resultados e aumentam as suas chances de ser aprovado para participar do estudo.
Antes de seguir para a etapa de avaliação, confira as orientações abaixo e garanta que tudo esteja de acordo, a fim de que o estudo prossiga sem dificuldades:
Levar um documento oficial com foto: RG ou CNH.
Dormir bem no dia anterior: isso ajuda nos resultados dos exames.
Evitar bebidas alcoólicas por pelo menos 48h antes da triagem.
Evitar atividade física intensa: pode alterar parâmetros clínicos.
Fazer jejum caso solicitado: conforme orientação da equipe.
Informar qualquer problema recente de saúde: transparência é essencial.
O que acontece na triagem clínica?
Durante a triagem clínica, alguns profissionais de saúde realizam avaliações completas para garantir que o participante está perfeitamente apto para o avanço dos estudos clínicos.
Avaliação médica: conversa sobre saúde, hábitos e histórico.
Exames laboratoriais: sangue e urina para verificar parâmetros gerais.
Sinais vitais: pressão arterial, temperatura, frequência cardíaca.
Eletrocardiograma (quando necessário): avaliação da atividade cardíaca.
Assinatura do TCLE: documento que explica direitos e deveres do participante.
A triagem não garante a participação — ela apenas confirma se a pessoa cumpre os critérios necessários. Cadastre-se agora e receba o convite assim que as vagas abrirem:
Etapas durante o estudo: como cada uma funciona
Antes de detalhar cada etapa, é importante entender que todos os estudos clínicos de bioequivalência seguem protocolos rigorosos, aprovados por Comitês de Ética, e contam com acompanhamento constante por equipes treinadas.
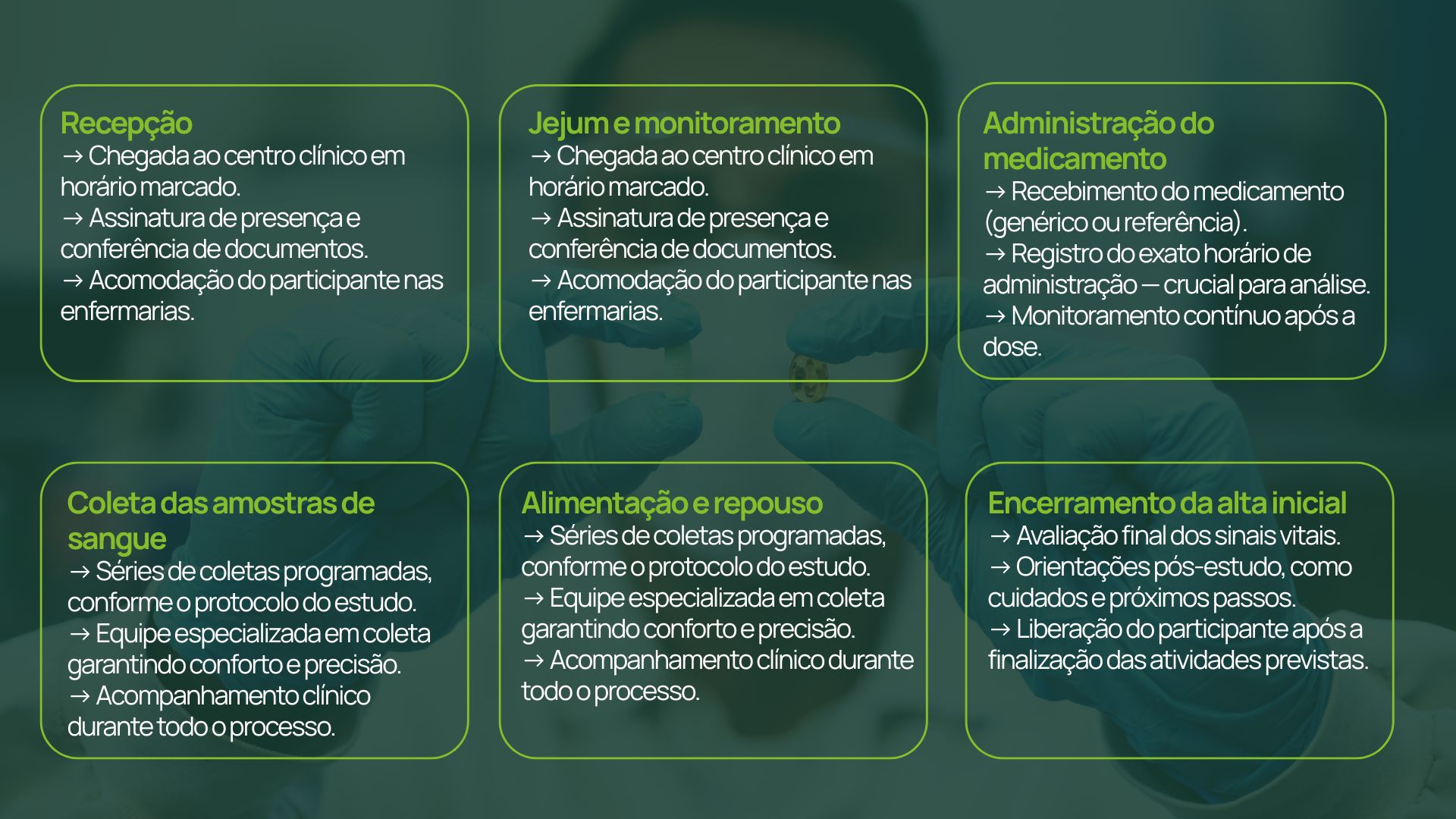
Você quer participar da pesquisa de bioequivalência da Synvia? Clique aqui para acessar o nosso Whatsapp e realizar a sua inscrição.
Regras e benefícios dos estudos clínicos de bioequivalência
Os estudos clínicos de bioequivalência seguem normas rigorosas para proteger o participante e garantir que todos os resultados alcançados sejam verdadeiramente confiáveis.
Essas regras existem para padronizar cada etapa do estudo, manter a segurança de todos e assegurar que os dados obtidos representem com precisão o comportamento do medicamento no organismo.
Antes de participar, é importante conhecer essas orientações. A seguir, você encontra as principais.
As regras dos estudos clínicos de bioequivalência
FAÇA | NÃO FAÇA |
✅ Siga os horários de jejum e alimentação. ✅ Informe qualquer mal-estar imediatamente. ✅ Traga documentos solicitados. ✅ Siga as orientações da equipe. | ❌ Não consuma álcool antes ou durante o estudo. ❌ Não pratique exercícios intensos nos dias anteriores. ❌ Não esconda informações médicas. ❌ Não tome medicamentos sem informar a equipe. |
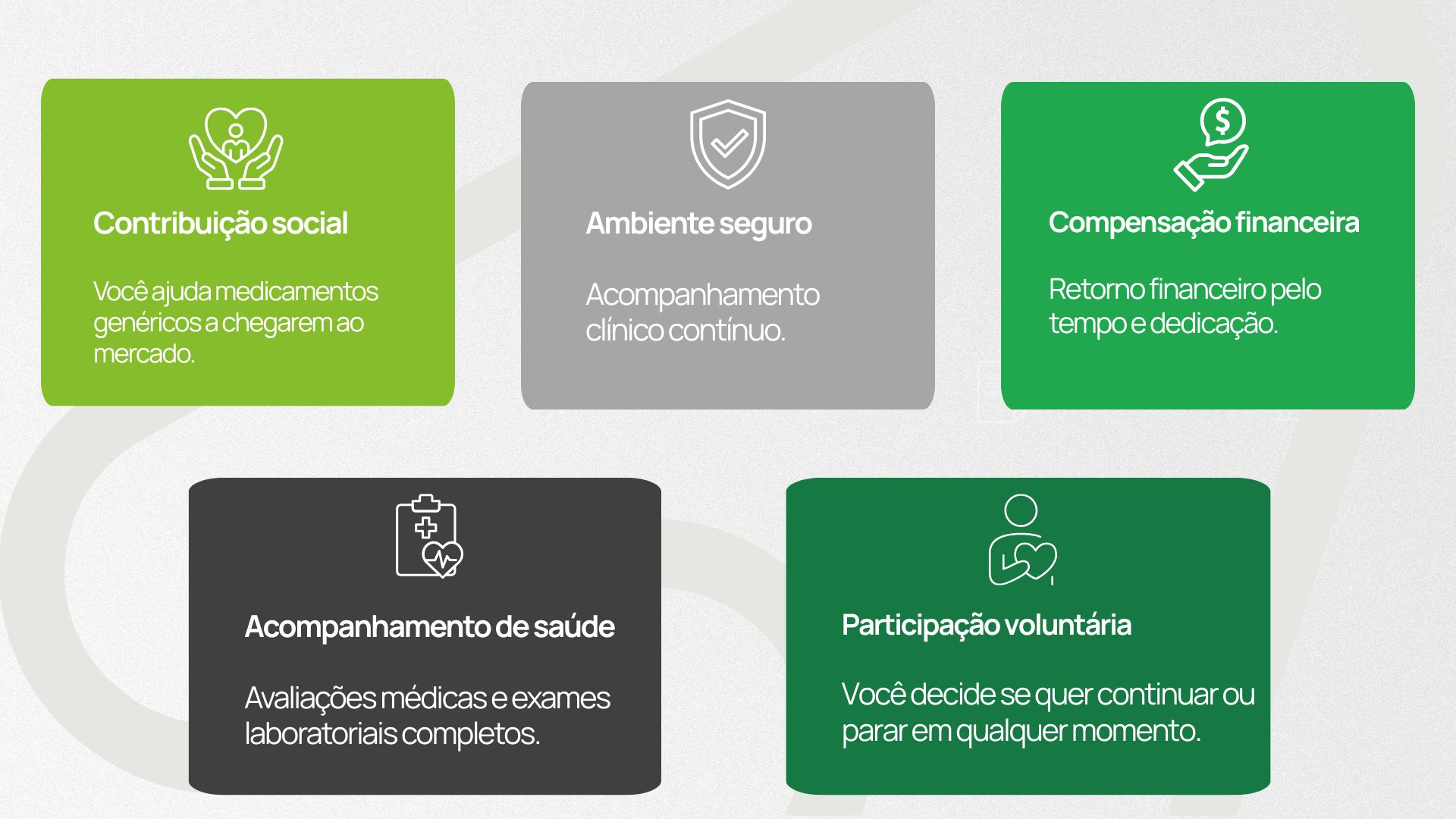
Benefícios de participar dos estudos de bioequivalência
Participar de estudos clínicos de bioequivalência é mais do que contribuir para o desenvolvimento de medicamentos genéricos seguros e assertivos.
O participante também recebe benefícios diretos que tornam a experiência positiva, estruturada e recompensadora:
Ética, segurança e transparência
A base de qualquer estudo clínico é a ética, e isso é especialmente verdadeiro nos estudos de bioequivalência conduzidos pela Synvia.
Todo o processo é estruturado para proteger o participante, oferecer total transparência e garantir que cada etapa seja acompanhada por profissionais habilitados.
Antes mesmo de começar, o participante recebe todas as informações necessárias para decidir se deseja participar e tem a garantia de que pode desistir a qualquer momento — sem justificativa e sem prejuízo.
Aprovados pelo Comitê de Ética em Pesquisa (CEP/CONEP).
Acompanhamento constante por médicos, enfermeiros e equipe técnica.
Explicação completa no TCLE antes de qualquer procedimento.
Direito de desistir a qualquer momento, sem justificativa.
Como participar do próximo estudo?
Participar dos próximos estudos clínicos de bioequivalência é simples e totalmente guiado pela equipe da Synvia. Basta preencher o seu cadastro clicando na imagem ao fim deste tópico e aguardar o contato para a triagem.
Assim que novas vagas forem abertas, os inscritos serão chamados em ordem de disponibilidade — por isso, quanto antes você se cadastrar, maior a chance de participar do próximo ciclo.
Se você deseja fazer parte dos próximos estudos, ajudar diretamente na liberação de medicamentos mais acessíveis e ainda ser recompensado por isso, basta realizar o seu cadastro e acompanhar as próximas etapas.
A sua participação é voluntária, totalmente segura e de extrema importância para que pesquisas importantes continuem acontecendo no Brasil.
QUER PARTICIPAR DO PRÓXIMO ESTUDO? Clique aqui, cadastre-se agora e receba prioridade nas próximas vagas. |
Dúvidas frequentes dos participantes em pesquisas de bioequivalência
1. O que exatamente é um estudo de bioequivalência? |
Um estudo de bioequivalência compara um medicamento genérico com sua versão de referência para verificar se ambos têm o mesmo comportamento no organismo — ou seja, se a absorção, distribuição e eliminação do princípio ativo acontecem de forma equivalente. Isso assegura que o genérico terá eficácia e segurança semelhantes ao original. |
2. Quem pode participar desses estudos? |
Podem participar pessoas saudáveis, dentro da faixa etária definida para o estudo, sem doenças crônicas, sem uso contínuo de medicamentos e aptas aos critérios de inclusão/exclusão que variam conforme o protocolo. |
3. Como faço para me inscrever e ser selecionado? |
Você começa com um cadastro — depois vem uma pré-triagem digital para avaliar elegibilidade. Se o perfil estiver de acordo, será agendado um check-up completo (exames laboratoriais, cardiológicos etc.). Com exames dentro dos parâmetros, você é convocado para participar do estudo. |
4. Preciso ser internado? Quanto tempo dura a participação? |
Depende do protocolo do estudo. Alguns exigem internação para coletas, monitoramento e administração do medicamento; outros podem ter parte ambulatorial. O tempo varia conforme o desenho do estudo, mas toda a logística (internação, exames, alimentação, repouso) é detalhada pela equipe da Synvia. |
5. Os estudos são seguros? Há risco para o participante? |
Sim — a segurança é prioridade: todos os protocolos são revisados e aprovados pelo Comitê de Ética em Pesquisa (CEP), e seguem normas nacionais e internacionais (incluindo regulação da ANVISA). Os participantes assinam o Termo de Consentimento Livre e Esclarecido (TCLE) antes de qualquer procedimento, recebem informações claras sobre riscos e podem desistir a qualquer momento. |
6. O que a Synvia oferece aos participantes como benefício? |
Os participantes têm acesso a exames e monitoramento médico gratuitos, acompanhamento de saúde, alimentação, estrutura confortável durante o estudo e compensação financeira pela participação — como retribuição pelo tempo investido e colaboração com a pesquisa. |
7. E se eu precisar desistir? Posso sair a qualquer momento? |
Sim. A participação é voluntária, e o voluntário pode desistir a qualquer momento, sem necessidade de justificar e sem prejuízo. Esse direito está garantido pela ética da pesquisa e expresso no TCLE. |
8. Os dados de saúde e pessoais ficam protegidos? |
Sim — a Synvia segue normas éticas e regulatórias que garantem privacidade e sigilo dos dados dos participantes. Informações pessoais e de saúde são tratadas com confidencialidade conforme legislação aplicável. |
9. Por que esses estudos são importantes para o Brasil? |
Sem os estudos de bioequivalência, genéricos não poderiam ser aprovados com segurança. Eles garantem que medicamentos genéricos tenham a mesma eficácia e segurança dos de referência — o que torna tratamentos mais acessíveis e democratiza o acesso à saúde no país. A Synvia, com sua estrutura, contribui diretamente para esse processo. |
10. Como sei quando há vagas para participar de um novo estudo? |
A inscrição começa por um cadastro (normalmente via site ou formulário indicado pela Synvia). Após o cadastro, você entra em uma base de dados de voluntários. Quando surgir um novo protocolo compatível com seu perfil, a equipe entra em contato para iniciar a triagem. |

